Solucionario Examen de admision unet 2008-2
Química
Bases Teóricas
Una sal ox(o) ácida, oxosal u oxisal es el resultado de la combinación de un hidróxido con un ácido oxácido, aunque también se pueden formar de una manera más simple por la combinación de un metal y un radical.
Características de las oxisales
- Las sales son compuestos que forman cristales.
- La mayoría de las sales son solubles en agua.
- La mayoría de los carbonatos metales alcalinos son poco solubles en agua.
- Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad.
- Fundidas o disueltas en agua, conducen la electricidad
¿Cómo se forman?
Las oxisales resultan de sustituir, total o parcialmente, los hidrógenos de un ácido oxiácido por metales. Para ello se parte del ácido del que proviene la sal cambiando el sufijo -oso por -ito y el -ico por -ato.
La forma más simple de formar una oxisal es generando el anión a partir del oxiácido correspondiente, de la siguiente forma:
El anión resulta por eliminación de los hidrógenos existentes en la fórmula del ácido. Se asigna una carga eléctrica negativa igual al número de hidrógenos retirados, y que, además, será la valencia con que el anión actuará en sus combinaciones.
Los aniones se nombran utilizando las reglas análogas que las sales que originan.
Nomenclatura IUPAC
Para nombrar las oxisales con la nomenclatura IUPAC primero se coloca el nombre del radical con el cual se está trabajando, seguido del nombre del metal que se utilizó y por último se escribe el número de oxidación de el metal, por ejemplo:
Ca+2 + (ClO2)-1 → Ca(ClO2)2 Clorito de Calcio II
Nomenclatura tradicional
En la nomenclatura tradicional primero se coloca el nombre del radical con el cual se está trabajando, seguido del nombre del metal que se utilizó y por último la terminación -oso para la valencia menor e -ico para la valencia mayor.
Ca+2 + (ClO2)-1 → Ca(ClO2)2 Clorito de Calcio
Radicales más comunes (Estúdiatelos)
Solución:
Bases Teóricas
Ley general del estado gaseoso: El volumen ocupado por la unidad de masa de un gas ideal, es directamente proporcional a su temperatura absoluta, e inversamente proporcional a la presión que se recibe.
Solución:
Bases Teóricas
Configuración electrónica :
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
 Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).

Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).

Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Solución:
Para ubicar el elemento en la tabla periódica, debemos conocer su número atómico (Z) .
Para conseguir el número atómico debemos tan solo conocer el número de electrones que posee el elemento.
Los supra-índices (Parte superior derecha) de :

,nos indican el número de electrones por tanto:
 ahora ubicamos un elemento en la tabla periódica cuyo número atómico (Z) sea igual a 28.
ahora ubicamos un elemento en la tabla periódica cuyo número atómico (Z) sea igual a 28.
Bases Teóricas
Una Solución Sobresaturada corresponde a aquella que contiene disuelto una cantidad de gramos de soluto mayor a la que corresponde para una solución saturada. La solución saturada es aquella en la cual sólo se distingue una fase y no sobra cantidad sólida de soluto. Las soluciones sobresaturadas son inestables, ya que basta sólo con agregar una pequeña cantidad de soluto o la agitación de la solución para provocar la preparación del exceso de soluto. El líquido circundante que queda después de esta separación corresponde a una solución saturada.
Solución:
Consideraciones:
- Todos los recipientes tienen la misma forma y capacidad.
- Todos los recipientes contienen 500ml de agua.
- A cada uno se le agrega una cierta cantidad de esferas, cuya solubilidad es 80g/l .
- Cada esfera tiene una masa de 10g.
Ahora analizando la solubilidad tenemos:
Hay 500ml(0.5l) de agua por tanto:
Estas nos indica que la solución es saturada en aquel recipiente que contenga 4bolas, pero para que la solución sea sobresaturada tendrá que haber una pequeña cantidad de soluto superior.
Conclusión: El recipiente con solución sobresaturada es aquel que tenga en su interior más de 4 bolas..”Que bolas” jajaja..
Bases Teóricas
La densidad de un cuerpo está relacionada con su flotabilidad, una sustancia flotará sobre otra si su densidad es menor. Por eso la madera flota sobre el agua y el plomo se hunde en ella, porque el plomo posee mayor densidad que el agua mientras que la densidad de la madera es menor, pero ambas sustancias se hundirán en la gasolina, de densidad más baja.
Solución:
- En el primer recipiente se puede observar que la densidad de “B” es mayor que la densidad de “A”
- En el segundo recipiente se puede observar que la densidad de “B” es mayor que la densidad de “C”
- Por tanto podemos concluir que el recipiente “B” tiene mayor densidad que “A” y “C”
Bases Teóricas
Los cicloalcanos son alcanos que tienen los extremos de la cadena unidos, formando un ciclo. Tienen dos hidrógenos menos que el alcano del que derivan, por ello su fórmula molecular es CnH2n. Se nombran utilizando el prefijo ciclo seguido del nombre del alcano.
Solución:
“El Ciclobutano es un hidrocarburo cíclico”
Bases Teóricas
En la atmósfera la presión disminuye rápidamente con la altura debido a que la cantidad de aire es menor al alejarnos de la superficie terrestre. Por lo tanto, al ir ascendiendo los valores medidos con un barómetro serán cada vez más pequeños. Este hecho es la base del funcionamiento de los Altímetros usados para medir alturas en las ascensiones de montañas.
La presión atmosférica no sólo cambia con la altura, sino que en cada punto va variando con la altura, lo que la convierte en un factor del tiempo meteorológico. En los mapas del tiempo podemos encontrar:
Anticiclones: Son zonas donde la presión atmosférica es alta debido a que el aire frío de las capas más altas desciende y en su descenso aumenta de temperatura. Por esta razón los anticiclones están asociados a un tiempo estable.
Borrascas: Son zonas donde la presión atmosférica es baja debido a que el aire asciende y en su ascenso la temperatura baja, condensándose el vapor de agua que pueda existir y produciendo lluvias. Por ello, las borrascas están asociadas a un tiempo inestable
Solución:
La Frase incorrecta es: “La presión atmosférica aumenta con la altura”
Bases Teóricas
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo. Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno, y además unido a otros dós átomos de carbono.
El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.
La propanona (comúnmente llamada acetona) es la cetona más simple.
Solución:
Bases Teóricas
Los óxidos ácidos
Los metales se combinan con el oxígeno molecular para formar los óxidos básicos correspondientes. De igual manera ocurre con los No Metales, entran en reacción con el Oxígeno molecular, dando origen a los llamados Óxidos Ácidos. A estos óxidos, durante mucho tiempo, se los llamó anhídridos. Uno de los más conocidos es el dióxido de carbono, que se elimina principalmente en la respiración de los animales y vegetales. También se produce en las combustiones de combustibles como el carbón, el petróleo y todos sus derivados, leña, papel, etc. Otro óxido de este grupo es el monóxido de carbono, gas tóxico. Cuando quemamos azufre, se forman vapores de color blanco, de olor sofocante, originados por la combinación del azufre con el oxigeno del aire, el compuesto se llama dióxido de azufre.Los óxidos ácidos o anhídridos están formados por la combinación de un No Metal y el Oxígeno molecular gaseoso. En forma simbólica:
No Metal + O2 ----------------------> Óxido Ácido o Anhídrido
Propiedades: Existen en la naturaleza una gran variedad de óxidos ácidos. Los óxidos de azufre, nitrógeno y carbono son los principales causantes del deterioro de la capa de ozono. Otros óxidos como el monóxido de carbono son tóxicos para el ser humano, se liberan de las estufas en ambientes poco ventilados. Y otros como los óxidos de nitrógeno, cloro y flúor, son altamente venenosos.
Nomenclatura
Tradicional: Los óxidos ácidos se llaman por esta nomenclatura anhídridos del elemento correspondiente. Con respecto al elemento no metálico, a los elementos monovalentes (se le agrega el sufijo -ico, a todos), a los elementos divalentes (se le agrega la terminación -oso para la menor valencia, e -ico para la mayor valencia con la que esté trabajando el elemento no metálico). Los elementos Azufre, Selenio y Telurio tienen tres valencias 2, 4, 6 los óxidos ácidos de estos elementos, sólo utilizan la valencias 4 (como la menor valencia) y 6 (como la mayor valencia), la valencia 2 NO se utilizará para la formación de óxidos ácidos, sino para formación de otros compuestos que veremos más adelante (hidruros no metálicos). Los elementos Cloro, Bromo y Iodo tienen cuatro valencias 1, 3, 5, 7 estos elementos no metálicos forman óxidos ácidos con todas sus valencias, pero se nombran teniendo en cuenta lo siguiente:

Numeral de stock: Los óxidos ácidos se llaman por esta nomenclatura óxido del elemento correspondiente, seguido de la valencia con que esté trabajando, expresada en números romanos.
Atomicidad: Se nombra la cantidad de átomos que constituyen al compuesto obtenido. Leyendo la fórmula molecular de atrás para adelante, utilizando los prefijos (mono-, di- , tri-, tetra-, penta-, hexa- o hepta-)
Solución:
Bases Teóricas
Entre las reacciones químicas más comunes y más importantes están las reacciones de óxido-reducción. Estas se caracterizan por que los átomos que participan en la reacción cambian su estado de oxidación ( EDO), tal como se ve en la siguiente reacción:
Cu+2 + Zn 0 ® Cu0 + Zn +2
El cobre comienza la reacción con EDO +2, mientras que el Zn lo hace con EDO 0, cuando se obtienen los productos tanto el cobre como el Zinc han cambiado su EDO. Como se produjo una variación en los EDO entonces podemos decir que la reacción es una reacción de Oxido reducción o simplemente REDOX.
Lo anterior implica en la mayoría de los casos, una transferencia de electrones entre los átomos, producto de esta transferencia electrónica se genera un cambio en el EDO. El EDO en buenas cuentas será: un número ya sea positivo, negativo o neutro que representa la carga que adquiere un átomo de acuerdo al número de electrones transferidos (ya sea ganados o cedidos). Como se puede ir concluyendo, para determinar si estamos frente a una reacción redox, debemos determinar en una primera etapa, si existen los cambios mencionados en los EDO, y para ello es necesario determinar previamente todos los EDO de reactivos y de productos. Esto se puede hacer en forma bastante simple aplicando algunas reglas básicas que permiten determinar el estado de oxidación.
Reglas para determinar los estados de oxidación
- El EDO de los elementos en su estado natural o fundamental es 0. El estado natural o fundamental significa que cada elemento se presenta como existe en la naturaleza.
Ejemplo: Na (s) = 0 Todos se representan como: Na 0 , Cl2 0, Cu 0
Cl2 (g) = 0
Cu (s) = 0
- El EDO del hidrógeno cuando se encuentra formando parte de compuestos es siempre +1, excepto en los hidruros metálicos, en que es -1
Ejemplo: HCl EDO del hidrógeno +1
H2SO4 EDO del hidrógeno +1
NaH EDO del hidrógeno -1 (Hidruro de sodio)
- En la mayor parte de los compuestos, el oxígeno actúa con EDO -2, a excepción de los peróxidos donde actúa con EDO -1.
Ejemplos: CuO EDO del oxígeno -2
H2O EDO del oxígeno -2
H2O2 EDO del oxígeno -2 (peróxido de hidrógeno).
- El número de oxidación de los metales alcalinos (grupo IA de la tabla periódica) es siempre es +1.
Ejemplo: NaCl EDO del Na +1
K2Br EDO del K +1
- El número de oxidación del los metales alcalinos térreos ( grupo II A de la Tabla periódica) es siempre +2
Ejemplo: MgCl2 EDO del Mg +2
- Los no metales de las sales de los hidrácidos de los elementos del grupo VI y VII de la tabla periódica, tienen respectivamente EDO -2 y -1.
Ejemplo: H2S EDO del S -2 (S, no metal del grupo VI A)
HCl EDO del Cl -1 (Cl , un no metal del grupo VII A)
- La suma de los estados de oxidación de moléculas neutras es siempre 0. De tal manera que conociendo uno de los EDO se puede determinar el otro.
Ejemplo 1 NaCl EDO del Na +1, suma del EDO del Na más del Cl igual a 0
Ecuación: +1 + X = 0
Despejando: X= 0 - (+1)
X = -1
Por lo tanto EDO del Cl es -1.
Ejemplo 2 H2SO4 EDO del H +1, EDO del O -2 , suma de los EDO igual 0
Ecuación 2 (+1) + X + 4 (-2) = 0
Despejando +2 + X + -8 = 0
X = +6
Luego el EDO del S es +6
- La suma de los EDO de moléculas cargadas es igual a su carga.
Ejemplo 1 (NO3)- EDO del O= -2, suma de los EDO = - 1
Ecuación X + 3 (-2) = - 1
Despejando X + (-6) = -1
X = +5
Luego el estado de oxidación del N es +5
Solución:
La suma de los estados de oxidación (EDO) del
 es igual a (-1).
es igual a (-1).
Ecuación:
Despejando:
Semireacción balanceada:
esto indica que el bromo gano 5 electrones
Bases Teóricas
Mezclas heterogéneas:no son uniformes; en algunos casos, puede observarse la discontinuidad a simple vista (sal y carbón, por ejemplo); en otros casos, debe usarse una mayor resolución para observar la discontinuidad.
Ejemplo: Agua con piedra, agua con aceite.
Característica de la mezcla: 2 fases (difásico)
2 componentes (agua y aceite)
Sistema binario (existen 2 componentes)
Las mezclas heterogéneas se pueden agrupar en: emulsiones, suspensiones y coloides. Emulsiones: Conformada por 2 fases líquidas inmiscibles. El diámetro de las partículas de la fase dispersa es aproximadamente ≤ 0.005 mm.
Ejemplo: agua y aceite, leche, mayonesa.
Suspensiones: Conformada por una fase sólida insoluble en la fase dispersante líquida, por lo cual tiene un aspecto opaco. Las partículas dispersas son relativamente grandes.
Ejemplo: Arcilla, tinta china (negro de humo y agua), pinturas al agua, cemento.
Solución:
“Una mezcla conformada por agua, cloruró de sodio y arena es una mezcla heterogénea”
Bases Teóricas
Los metales alcalinos son aquellos que están situados en el grupo IA de la tabla periódica (excepto el Hidrógeno que es un gas). Todos tienen un solo electrón en su nivel energético más externo, con tendencia a perderlo (esto es debido a que tienen poca afinidad electrónica, y baja energía de ionización), con lo que forman un ion monopositivo, M+. Los alcalinos son los del grupo I A y la configuración electrónica del grupo es ns¹. Por ello se dice que se encuentran en la zona "s" de la tabla.
Solución:
“Los metales alcalinos son Li, Na, K, Rb, Cs, Fr”
Bases Teóricas
Reactivo limitante
Es aquel reactivo concreto de entre los que participan en una reacción cuya cantidad determina la cantidad máxima de producto que puede formarse en la reacción.
El orden que se debe seguir para resolver un problema directo es:
- Verificar si la ecuación está balanceada y si no lo está balancearla.
- Tener en cuenta la pureza de los reactivos. O si la cantidad de reactivo no está dada directamente, calcularla.
- Calcular el reactivo limitante.
- Hacer los cálculos estequiométricos en base al Reactivo Limite.
- Tener en cuenta el rendimiento de la reacción.
Solución:
Si deseas descargar el examen resuelto en formato .Pdf , Haz click sobre el dragon(si no carga el .pdf pasados 10seg. haz click derecho sobre el dragon con el raton y luego das click en Guardar enlace como.....ejm: Aqui)
 (0276) 3419570
(0276) 3419570
 (0416) 1795862
(0416) 1795862
 (0414) 7039135
(0414) 7039135
Correo Electrónico: nbp_asesorias_academicas@hotmail.com
 Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+). es igual a (-1).
es igual a (-1). 










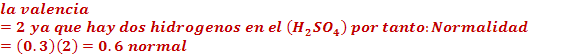






































No hay comentarios:
Publicar un comentario